Trabajo Realizado Por Estudiantes De Tecnología En Química Industrial del SENA En Cuanto A La Identificación Microbiana De Los Microorganismos Posibles, En Una Muestra De Almidón De Papa Criolla.
Integrantes:
Jennifer Guaidia
Carolina Moreno
Derly Vargas
Diego Patiño
Diego Morales
Objetivo general
Determinar la presencia de distintos microorganismos en el almidon de la papa criolla
Objetivos
- Realizar la preparación de diferentes medios de cultivo (nutritivo y PDA).
- Conocer la importancia de la esterilización de los medios de cultivo y los materiales en el plan de aislamiento.
- Realizar diferentes técnicas de aislamiento para obtener un cultivo puro de microorganismos.
- Identificar microscópicamente y macroscópicamente los distintos microorganismos y hacer el respectivo conteo.
- Realizar pruebas bioquímicas para identificar los distintos microorganismos.
- Aprender a interpretar pruebas bioquímicas de identificación bacteriana.
Introducción
En este blog se encuentra todos los pasos y documentación utilizada para elaborar la Identificación Microbiana de los Microorganismos Presentes en una Muestra de Almidón de Papa Criolla.
En la primera parte encontraremos temas referentes a muestra que vamos a determinar, tipos de microorganismos, medios de cultivos, soluciones diluyentes, reactivas y colorantes, equipos, y los objetivos de esta práctica en general.
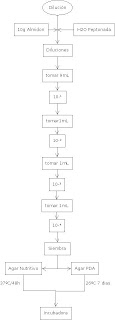
En la segunda parte podemos ver los pasos y parámetros para preparar los medios de cultivo, agregando también un diagrama de flujo que nos podría facilitar esta practica. Mas adelante podemos localizar las diluciones que se realizaron, un diagrama de flujo con cada uno de los pasos que se siguieron y adjunto a esto unas imágenes que nos enseñan cada unas de las siembras que creamos.
Por otra parte se hará referencia a la técnica de re cuento en placa y se mostraran algunas imágenes de esta práctica.
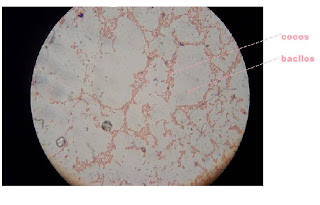
Para analizar mas a fondo que tipos de microorganismos han surgido de estas siembras desarrollamos una Descripción Macro y Microscópica a cada una de las colonias existentes, en la cual se dan todas las características posibles en cuanto a su tamaño, su forma, su color, fotos etc.
Se analizara también el concepto de Aislamiento de Cultivo axeníco y toda su metodología con unas gráficas que nos pueden servir para facilitar la práctica.
Finalmente encontraremos la descripción de cada unas de las pruebas bioquímicas que realizamos para especificar mas características del el microorganismo que se encuentra en el almidón.
Desarrollo Teórico
Almidón
es un polisacárido de reserva alimenticia predominante en las plantas,constituido por amilasa y amilopectina.Proporciona el 70-80% de las calorías consumidas por los humanos de todo el mundo. Tanto el almidón como los productos de la hidrólisis del almidón constituyen la mayor parte de los carbohidratos digestibles de la dieta habitual. Del mismo modo, la cantidad de almidón utilizado en la preparación de productos alimenticios, sin contar el que se encuentra presente en las harinas usadas para hacer pan y otros productos de panadería.
es un polisacárido de reserva alimenticia predominante en las plantas,constituido por amilasa y amilopectina.Proporciona el 70-80% de las calorías consumidas por los humanos de todo el mundo. Tanto el almidón como los productos de la hidrólisis del almidón constituyen la mayor parte de los carbohidratos digestibles de la dieta habitual. Del mismo modo, la cantidad de almidón utilizado en la preparación de productos alimenticios, sin contar el que se encuentra presente en las harinas usadas para hacer pan y otros productos de panadería.
Caldo nutritivo
Medio de cultivo utilizado para propósitos generales, para el desarrollo de microorganismos con escasos requerimientos nutricionales.
Su uso está descrito en muchos procedimientos para el análisis de alimentos, aguas y otros materiales de importancia sanitaria.
Fundamento
Medio no selectivo, contiene pluripeptona y extracto de carne que constituyen la fuente de carbono y nitrógeno necesarios para el adecuado desarrollo bacteriano.
Puede ser utilizado además, como preenriquecimiento en la búsqueda de Salmonella spp. a partir de alimentos, ya que permite recuperar células dañadas, diluir metabolitos tóxicos y sustancias inhibitorias.
Siembra:
Por inoculación directa de la muestra o del microorganismo en estudio.
Incubación:
En aerobiosis, a 35-37 ºC durante 24 horas.
Agar nutritivo
Medio de cultivo utilizado para propósitos generales, para el aislamiento de microorganismos poco exigentes en lo que se refiere a requerimientos nutritivos.
Su uso está descrito en muchos procedimientos para el análisis de alimentos, aguas y otros materiales de importancia sanitaria.
Fundamento
Por las características de sus componentes es un medio usado para el cultivo de microorganismos poco exigentes en sus requerimientos nutricionales. No contiene inhibidores del desarrollo bacteriano. La pluripeptona es la fuente de carbono y nitrógeno para el desarrollo bacteriano. El agregado de cloruro de sodio permite el enriquecimiento con sangre de carnero u otras sustancias para facilitar el cultivo de microorganismos exigentes.
Siembra:
En superficie o por la técnica de pour plate, según el uso a que se destine.
Incubación:
En aerobiosis, a 35-37 ºC durante 24 horas.
PDA para hongos (Potato Dextrosa Agar)
El medio PDA tiene en su formulación dextrosa como fuente carbonada, este compuesto lo hace selectivo para hongos ya que sólo éstos pueden degradarlo, si tuviera otra fuente de carbono como glucosa también crecerían bacterias.
Para la elaboración del medio PDA, el procedimiento es mucho más sencillo puesto que ya está comercializado en polvo y sólo es necesario disolverlo en agua destilada (en las proporciones adecuadas) y agitar.
Incubación:
Incubar las placas sin invertirlas a temperatura de salón (20-240C) en luz, pero evitar que sea directa. Examinar y contar las colonias en las placas luego de 3, 5 y 7 días.
Conteo e inventario:
El conteo de hongos en una placa proveerá la base para comparaciones cuantitativas entre muestras tomadas en distintas localidades. El inventario nos hablará de la abundancia de especies de hongos en la zona. Descartar placas con más de 300 colonias.
Se puede calcular el número de hongos por volumen de agua en las muestras y así comparar varios sitios muestreados.
# de hongos/ ml de muestra = suma del número de colonias en las 5 placas X dilución de una misma dilución
Para realizar un inventario se deberá utilizar el microscopio para ver morfología y estructuras reproductivas que ayuden en la clasificación de las especies.